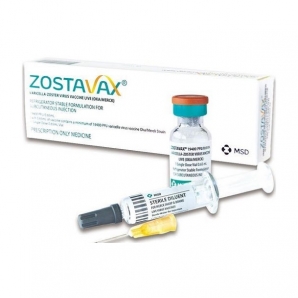
상품상세정보
외형정보
· 성상 : 동결건조된 흰색의 결정성 건조제제가 들어있는 바이알
성분정보
약독수두생바이러스 19400PFU
저장방법
밀봉용기, 2~8℃에서 냉장보관
효능효과
만 50세 이상의 성인에서의 대상포진의 예방
용법용량
이 백신은 1회 0.65㎖ 피하주사하며, 상완부 (삼각근 부위)에 주사하는 것이 선호된다. 혈관내 또는 근육 주사를 하여서는 안된다.
- 조제 및 투여방법
이 약과 함께 제공된 주사기내 첨부용제를 동결건조된 백신이 들어있는 바이알에 모두 넣고 완전히 혼화되도록 흔든다. 이 백신은 조제시 약간 흐리거나 반투명의 회색 빛이 도는 흰색 또는 연한 노란색의 액체이다. 용해액 전량을 주사기에 취한 후 0.65㎖피하 주사한다. 역가 손실을 최소화하기 위하여 조제 후 즉시 백신을 투여하여야 하며, 조제 후 30분 이내 사용하지 않은 백신은 폐기하여야 한다.
이 약은 냉장보관해야 하며 냉장고에서 꺼낸 후 즉시 조제한다. 또한 조제된 백신을 냉동하여서는 안 된다.이 약의 조제 및 투여 시 별도의 무균 주사침을 사용한다.
사용된 바늘은 적절하게 처리하며 다시 사용되어서는 안 된다.
사용상 주의사항
1. 다음 환자에는 투여하지 말 것
1) 젤라틴 등 이 백신의 구성 성분에 대해 과민반응이 있는 자
2) 네오마이신에 대해 아나필락시스/아나필락시스 유사 반응의 병력이 있는 자 (용해된 각 백신에는 미량의 네오마이신이 포함된다). 다만, 접촉성 피부염으로 발현되는 네오마이신 알레르기는 이 백신 접종의 금기 대상은 아니다.
3) 원발성 및 다음의 조건으로 인한 후천성 면역결핍 상태에 있는 환자: 급성 및 만성 백혈병, 림프종 또는 골수/림프계에 영향을 미치는 기타 상황, HIV/AIDS에 의한 면역억제(2. 약물이상반응 참고), 세포성 면역결핍.
4) 고용량의 코르티코스테로이드를 포함하여 면역억제요법을 받고 있는 환자(2. 약물이상반응 참고), 그러나 국소/흡입용 코르티코스테로이드 또는 저용량의 전신 코르티코스테로이드를 투여 받고 있는 자와 부신기능부전에 대한 대체요법으로서 코르티코스테로이드를 투여 받고 있는 경우는 이 백신의 금기 대상이 아니다. 조스타박스는 약독화된 대상포진생바이러스 백신으로 면역억제환자 또는 면역결핍환자에게 투여 시 치명적인 결과를 포함한 수두-대상포진 바이러스 관련 파종성 질환이 나타날 수 있다.
5) 치료받고 있지 않는 활동성 결핵 환자
6) 임부 또는 임신 가능성이 있는 여성 (5. 임부 및 수유부에 대한 투여 1) 임부 항 참조)
2. 약물이상반응
이 백신은 만 50세 이상 성인, 약 32,000명을 대상으로 한 임상시험을 통해 전반적인 안전성을 평가하였다.
1) 만 50 – 59세 피험자에서의 백신 유효성 및 안전성 시험 (ZOSTAVAX Efficacy and Safety Trial, ZEST)
백신 유효성 및 안전성 시험(ZEST)에서 피험자는 이 백신(n=11,184) 또는 위약(n=11,212)을 1회 투여 받았으며 시험기간 동안 전반적인 안전성을 모니터하였다. 시험기간 동안, 백신 관련 중대한 이상사례가 백신 투여군에서 1명(아나필락시스 반응) 보고되었다.
2) 만 60세 이상 피험자에서의 대상포진 예방 시험 (Shingles Prevention Study, SPS)
최대 규모로 진행된 대상포진 예방 시험(SPS)에서 총 38,546명이 이 백신(n=19,270) 또는 위약(n=19,276)을 1회 투여 받았으며 시험기간 동안 안전성을 모니터하였다. 시험기간 동안, 백신 관련 중대한 이상사례가 백신 투여군에서 2명(천식 악화, 류마티스성 다발성 근육통) 및 위약 투여군에서 3명(굿파스처증후군;Goodpasture's syndrome, 아나필락시스, 류마티스성 다발성 근육통)에서 보고되었다.
1% 이상 보고된 이상사례는 이 백신 투여군과 위약군에 대해서 각각 다음과 같이 나타났다.
호흡기감염(1.9% 및 1.7%), 발열(1.8% 및 1.6%), 독감증후군(1.7% 및 1.6%), 설사(1.5% 및 1.3%), 비염(1.4% 및 1.1%), 피부장애(1.1% 및 1.0%), 호흡기장애(1.1% 및 0.8%), 무력감(1.0% 및 0.4%)
이상사례 모니터링 소집단에 포함되지 않은 다른 피험자에 대해서는 백신접종보고카드 없이 정기적인 안전성 모니터링을 실시하였으며, 모니터링 소집단에서 보고된 것과 대체로 유사하였다.
3) 백신 접종 후 수두-대상포진 발진
백신 유효성 및 안전성 시험(ZEST)에서 접종 후 42일 동안의 보고 기간에 비-주사부위 대상포진-유사 발진은 34명의 피험자에서 보고되었다 (백신 투여군 19명, 위약 투여군 15명). 이 중 중합효소 연쇄 반응 (Polymerase Chain Reaction, PCR) 시험에 적합한 24건의 표본에 대해 PCR 시험을 하였을 때, 10건(백신 투여군 3건, 위약 투여군 7건)에서 야생형 수두-대상포진 바이러스(Varicella-Zoster Virus)가 검출되었으며, 수두-대상포진 바이러스 Oka/Merck 백신 균주가 검출된 표본은 없었다. 또한 동 기간 중 보고된 수두-유사 발진(n=124, 백신 투여군 69명 및 위약 투여군 55명) 중 PCR 시험에 적합한 23건의 표본에서는 수두-대상포진 바이러스가 백신 투여군에서 1건 검출되었으나, 바이러스형(야생형 또는 Oka/Merck주)은 판정할 수 없었다.
대상포진 예방시험(SPS)에서 접종 후 42일 동안의 보고 기간에 모든 피험자에서 보고된 비-주사부위 대상포진-유사 발진은 백신 투여군 17건, 위약 투여군 36건에서 발생하였으며(p=0.009), 이 중 PCR 시험에 적합한 41건의 표본에 대해 PCR 시험을 하였을 때, 25건(백신 투여군 5건, 위약 투여군 20건)에서 야생형 수두-대상포진 바이러스가 검출되었으며, 수두-대상포진 바이러스 Oka/Merck 백신 균주가 검출된 표본은 없었다. 또한 동 기간 중 보고된 수두-유사 발진(n=59) 중 PCR 시험에 적합한 10건의 표본에서는 수두-대상포진 바이러스가 검출되지 않았다.
한편, 이 백신(냉동보관제형)의 최초 허가의 근거가 되는 또 다른 임상시험에서 백신 접종 후 42일 내에 17건의 비-주사부위에서의 대상포진 발진 및 수두-유사 발진이 발생하였다. 이중 10건의 표본에서 PCR 시험이 가능하였으며 수두-유사발진을 보인 2명의 피험자의 병변 부위에서 Oka/Merck 백신 균주가 확인되었다.
4) 기타 임상시험
① 불활화 인플루엔자 백신과의 병용 투여 시험을 포함한 만 50세 이상의 피험자에서의 안전성 프로파일은 대상포진 예방시험(SPS)의 이상사례 모니터링 소집단에서 관찰된 것과 유사하였다. 그러나 이 시험들에서 만 50-59세의 피험자에서 경도 내지 중등도의 주사부위 이상사례의 발생률이 만 60세 이상의 피험자보다 더 높게 나타났다.
② 이 백신의 2차 접종시의 안전성 및 내약성을 평가하였다. 위약대조, 이중눈가림 시험에서 만 60세 이상의 98명의 성인들에 대해 이 백신의 1차 접종으로부터 42일 후 2차 접종을 하였다; 2차 접종 후 백신 관련 이상사례의 발생 빈도는 1차 접종시와 유사하였다.
③ 백신 접종 전 대상포진 병력이 있는 만 50세 이상의 피험자 100명에게 이 백신을 투여한 이중눈가림, 위약대조, 무작위배정 임상시험에서 관찰된 안전성 프로파일은 대상포진 예방시험(SPS)의 이상사례 모니터링 소집단에서 관찰된 것과 전반적으로 유사하였다.
④ 수두대상포진바이러스-혈청음성 또는 낮은 혈청양성 피험자에 대한 2건의 임상시험에서 얻어진 제한적인 자료에 의하면 (만 30세 이상 성인 27명에게 약독화 대상포진 생바이러스 백신을 접종), 주사부위 및 전신 이상사례는 임상시험에서 이 백신을 접종한 피험자에서 보고된 이상사례와 전반적으로 유사하였으며, 27명 중 2명의 피험자가 발열을 보고하였다. 수두-유사 발진 또는 대상포진-유사 발진은 보고되지 않았다. 백신 관련 중대한 이상사례는 보고되지 않았다.
5) 시판 후 이상사례
이 백신의 시판 후 이상사례는 다음과 같이 보고되었다. 이러한 이상사례는 불특정 규모의 인구 집단에서 자발적으로 보고되었으므로, 해당 이상사례 발생률을 추정하거나 또는 이 백신과의 인과관계를 확립하는 것은 일반적으로 가능하지 않다.
① 피부 및 피하조직: 발진
② 근골격계 및 결합조직: 관절통, 근육통
③ 일반적 및 주사부위: 주사부위 발진; 주사부위 두드러기; 발열; 일시적인 주사부위 림프절병증
④ 면역계: 아나필락시스 반응 등의 과민반응
⑤ 위장관 장애: 메스꺼움
⑥ 눈 장애: 괴사성 망막염 (면역억제 요법을 받고 있는 환자 경우)
⑦ 감염 및 감염증: 수두-대상포진 바이러스 (백신 균주)
⑧ 신경계 장애: 길랑바레증후군, 안면마비
6) 국내 사용성적조사에서 확인된 이상사례
- 국내에서 4년 동안 769명을 대상으로 실시한 시판 후 사용성적조사 결과, 이상사례 발현율은 17.17%(132명/769명, 229건)이었고, 이 중 본제와 인과관계를 배제할 수 없는 약물이상반응 발현율은 15.08%(116명/769명, 204건)로, 주사 부위 통증 8.58%(66명/769명, 66건), 주사 부위 부종 6.24%(48명/769명, 48건), 주사 부위 홍반 4.81%(37명/769명, 37건), 주사 부위 가려움증 2.86%(22명/769명, 22건), 발열 0.65%(5명/769명, 5건), 권태, 두통 각 0.52%(4명/769명, 4건), 피로 0.39%(3명/769명, 3건), 통증, 주사부위 발진, 근육통 각 0.26%(2명/769명, 2건), 열감, 가슴 통증, 주사 부위 혈종, 주사부위 두드러기, 오심, 소화불량, 관절통, 가려움증, 두드러기 각 0.13%(1명/769명, 1건)이 보고되었다.
- 중대한 이상사례 발현율은 0.13%(1명/769명, 1건)로, 전립선암 0.13%(1명/769명, 1건)이 보고되었으며, 이 약과의 투여ㆍ사용과의 인과관계는 가능성이 적은(unlikely) 것으로 평가되었다. 중대한 약물이상반응은 확인되지 않았다.
- 예상하지 못한 이상사례 발현율은 3.64%(28명/769명, 34건)로, 권태, 피로 각 0.52%(4명/769명, 4건), 통증, 오심 각 0.39%(3명/769명, 3건), 소화불량, 변비 각 0.26%(2명/769명, 2건), 열감, 가슴 통증, 입안염, 십이지장 궤양, 치질, 위장관 장애, 입술염, 입술통증, 가려움증, 두드러기, 코인두염, 헤르페스 피부염, 적응장애, 요추척추관 협착, 기침, 전립선암 각 0.13%(1명/769명, 1건)로 보고되었다. 예상하지 못한 약물이상반응 발현율은 1.56%(12명/769명, 15건)로, 권태 0.52%(4명/769명, 4건), 피로 0.39%(3명/769명, 3건), 통증 0.26%(2명/769명, 2건), 열감, 가슴 통증, 오심, 소화불량, 가려움증, 두드러기 각 0.13%(1명/769명, 1건)이었다.
- 중대하고 예상하지 못한 이상사례 발현율은 0.13%(1명/769명, 1건)로, 전립선암 0.13%(1명/769명, 1건)이었으며, 이 약과의 투여ㆍ사용과의 인과관계는 가능성이 적은(unlikely) 것으로 평가되었다. 이중 중대하고 예상하지 못한 약물이상반응은 확인되지 않았다.
7) 이 약에 대한 국내 재심사 이상사례 및 자발적 부작용 보고자료를 국내 시판 허가된 모든 의약품을 대상으로 보고된 이상사례 보고자료와 재심사 종료시점에서 통합 평가한 결과, 다른 모든 의약품에서 보고된 이상사례에 비해 이 약에서 통계적으로 유의하게 많이 보고된 이상사례 중 새로 확인된 것들은 다음과 같다. 다만, 이 결과가 해당성분과 다음의 이상사례 간에 인과관계가 입증된 것을 의미하는 것은 아니다.
- 전신적 질환: 피로, 권태
- 호흡기계 질환: 상기도 감염
3. 일반적 주의
1) 의사는 백신 접종자에게 이전의 수두-대상포진 바이러스 함유 백신의 접종 후 반응에 관하여 문진한다.
2) 이 백신은 만 50세 이상의 성인에서 대상포진 예방을 위해 투여해야 한다.
3) 수두의 예방목적으로 이 백신을 사용하여서는 안 된다.
4) 이 백신은 정상적인 면역반응이 유도될 수 있는 사람에게 접종함을 원칙으로 한다.
5) 이 백신을 대상포진 또는 대상포진 후 신경통(Post Herpetic Neuralgia)의 치료 목적으로 사용해서는 안 된다.
6) 다른 백신과 마찬가지로, 접종 후 아나필락시스/아나필락시스 유사 반응이 나타날 수 있으므로 즉시 사용할 수 있도록 에피네프린 주사(1:1000)를 포함하여 적절한 응급조치를 구비한다.
7) 38.5℃를 초과하는 발열 등의 급성 병증이 있는 경우, 백신 접종 연기를 고려하여야 한다.
8) 다른 백신과 마찬가지로, 이 백신이 모든 접종자에게 예방 효과가 있는 것은 아니다. 이 백신은 임상시험을 통해 4년간 백신의 예방효능이 입증되었으며 그 이후 추가접종의 필요성 여부는 명확하지 않다.
9) 이 백신을 여러 번 접종한 경우에 대한 유효성은 확립되지 않았다. 2차 접종에 대한 필요성은 확실하지 않다.
10) 이 백신의 임상시험에서 백신의 바이러스 전파는 보고되지 않았다. 그러나 수두 백신의 시판 후 보고사례에서 수두-유사 발진을 보이는 백신 접종자와 감수성이 있는 접촉자 사이에 드물게 백신의 바이러스 전파가 발생할 수 있다고 제시되었다. 수두-유사 발진을 나타내지 않은 수두 백신 접종자로부터의 백신 바이러스 전파가 보고된 바 있다.
11) 이 백신이 기계 또는 운전 조작 등에 미치는 영향은 평가되지 않았다.
4. 상호작용
1) 이 백신은 불활화 인플루엔자 백신과 병용투여 가능하다.
2) 이 백신과 수두-대상포진 바이러스에 유효한 것으로 알려진 항바이러스 약물을 동시 투여하였을 때 유효성은 평가되지 않았다.
3) 이 백신과 프로디악스-23의 병용투여는 이 백신의 면역원성을 감소시키므로, 이 백신과 프로디악스-23은 병용투여하지 않으며, 만약 두 백신의 접종이 필요할 경우, 두 백신은 최소 4주 이상의 간격을 두고 접종할 것을 고려하여야 한다.
5. 임부 및 수유부에 대한 투여
1) 이 백신에 대한 동물에서의 생식독성시험은 실시되지 않았으며 또한 이 백신을 임부에 투여 시 태아에 해를 끼치거나 생식능에 영향을 미치는지 여부는 알려져 있지 않다. 그러나 자연적으로 발생하는 수두대상포진 바이러스 감염은 때때로 태아에 유해한 영향을 미치는 것으로 알려져 있으므로 임부에게 접종하지 않는다; 또한, 백신 접종 후 3개월 간 임신을 피해야 한다 (1. 다음 환자에는 투여하지 말 것 항 참조).
2) 수두-대상포진 바이러스가 사람 유즙으로 분비되는지는 알려져 있지 않다. 그러나 일부 바이러스가 사람 유즙으로 분비되므로, 이 백신을 수유부에 투여해서는 안 된다.
6. 소아에 대한 투여
이 백신을 수두의 예방목적 등으로 소아에게 사용하지 않는다.
7. 고령자에 대한 투여
이 백신의 최대 규모의 임상시험(N=38,546)에 등록된 피험자의 연령의 중간값은 만 69세였다(범위 만 59-99세). 이 백신을 투여 받은 19,270명의 피험자 중 10,378명은 만 60 – 69세였고 7,629명은 만 70 – 79세였으며 1,263명은 만 80세 이상이었다.
8. 보관 및 취급상의 주의사항
1) 어린이의 손이 닿지 않는 곳에 보관하도록 주의한다.
2) 다른 용기에 바꾸어 넣는 것은 사고원인이 되거나 품질 유지 면에서 바람직하지 않다.
3) 이 백신과 다른 약물을 한 주사기에 혼합하여 사용해서는 안 된다.
9. 전문가용 정보
1) 약리작용 정보
대상포진 발생의 위험은 수두-대상포진 바이러스(VZV) 특이적인 면역의 감소와 연관이 있다. 이 백신은 수두-대상포진바이러스 특이적인 면역을 증강시키며, 이것이 대상포진 및 그 합병증을 예방하는 기전으로 생각된다.
배송안내
- 배송비 : 기본 배송료는 의약품/의료소모품 4,900원 입니다.
- 의약품/의료소모품 70,000원 이상 구매 시 무료배송입니다. (기초수액제 및 일부품목 제외)
- 기초수액제는 1Box단위로 배송비가 별도 부과됩니다.
- 본 상품의 평균 배송일은 입금확인 후 2~3일이며 상품의 종류에 따라 배송기간은 달라질 수 있습니다.
- 배송예정일은 주문시점(주문순서)과 제품 재고 여부에 따라 평균 배송일과는 차이가 발생할 수 있는점 양해 부탁드립니다.
- 사업자 등록증 주소지로만 배송이 가능합니다.
교환 및 반품안내
- 상품수령 후 7일이내 교환 및 반품이 가능합니다.
- 교환 및 반품 절차
교환 및 반품신청 → 택배사 상품회수 → 반품 확인 → 교환 및 환불 완료
- 상품 포장을 개봉하였거나 포장이 훼손되어 상품가치가 상실된 경우,
상품에 낙서 또는 필기가 되어있는 경우 교환 및 반품이 불가합니다.
- 특수상품(향정 및 생물학적제제)은 교환 및 반품이 불가능합니다.
- 일부 특가 이벤트 상품은 교환 및 반품이 불가할 수 있습니다. (제품불량 또는 오배송 제외)
- 고객님의 단순 변심에 의한 교환 및 반품은 왕복 배송비가 부과되는점 양해 부탁드립니다.
환불안내
- 환불 시 반품 여부 확인 후 영업일 3일 이내에 결제 금액을 환불해 드립니다.
- 신용카드 결제시에는 기간에 따라 대금이 청구될 수 있으며 이러한 경우 익월 신용카드 대금청구시 카드사에서 환급처리 됩니다.
- 반품 및 환불에 대한 추가 사항은 고객센터 (02-457-5118)로 문의 주시면 안내드리겠습니다.
AS안내
- 의약품 및 의료소모품은 A/S가 불가합니다.
- 제품 이미지(사진)는 참고용으로 실제 제품과는 다를 수 있습니다.
장바구니 담기
상품이 장바구니에 담겼습니다.
바로 확인하시겠습니까?


 공지사항
공지사항 고객문의
고객문의![[생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진 [생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진](https://godomall.speedycdn.net/4b78ba1d2641031ee2c63c5f98411483/goods/1000001723/image/detail/1000001723_detail_050.jpg)
![[생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진 [생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진](https://godomall.speedycdn.net/4b78ba1d2641031ee2c63c5f98411483/goods/1000001723/image/magnify/1000001723_magnify_05.jpg)
![[생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진 [생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진](https://godomall.speedycdn.net/4b78ba1d2641031ee2c63c5f98411483/goods/1000001723/image/detail/thumb/1000001723_detail_050.jpg)
![[생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진 [생물]조스타박스주(1V)_대상포진생바이러스백신_대상포진](https://godomall.speedycdn.net/4b78ba1d2641031ee2c63c5f98411483/goods/1000001723/image/magnify/thumb/1000001723_magnify_05.jpg)